Leitung: Dr. Lukas Menges
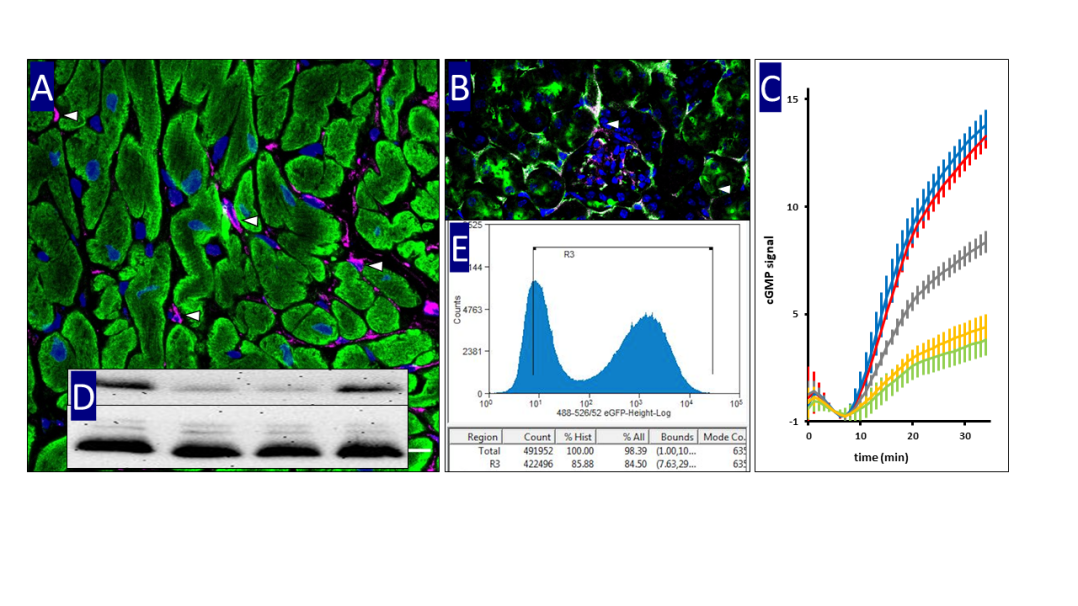
Das kardiorenale System beschreibt das enge Zusammenspiel von Herz und Nieren bei der Regulation von Blutdruck und Flüssigkeitshaushalt, wobei Störungen eines Organs das andere mit beeinträchtigen können. Gesteuert wird dieses Zusammenspiel durch biochemische Signalkaskaden, also molekulare Kettenreaktionen, die ein äußeres Signal in eine gezielte Zellantwort übersetzen. Ein wichtiges Beispiel ist die NO/cGMP-Kaskade: Stickstoffmonoxid (NO) wird in Gefäßzellen gebildet, aktiviert in Zielzellen die Guanylatzyklase und erhöht den cGMP-Spiegel, was zu Gefäßerweiterung, Blutdrucksenkung und damit zu einer Entlastung von Herz und Nieren führt.
In unseren Forschungsprojekten untersuchen wir unter anderem die Präsenz, Regulation und subzelluläre Lokalisation von cGMP-Signalen in kardialem und renalem Gewebe. Hierfür setzen wir verschiedene biochemische Methoden wie Western Blotting und qPCR sowie molekularbiologische Verfahren ein, darunter immunhistochemische Färbungen, Fluoreszenzmikroskopie, Durchflusszytometrie und gentechnische Methoden wie Transfektionen. Unsere experimentellen Arbeiten basieren sowohl auf humanen Zelllinien als auch auf murinen Zellen und Gewebeproben.
Ergänzend untersucht die Arbeitsgruppe Transportmechanismen, die für den Stoffwechsel und die kardiovaskuläre Gesundheit relevant sind. Im Fokus steht dabei der ABC-Transporter ABCG2, der die Harnsäureausscheidung im Darm reguliert. Wir erforschen, wie genetische Varianten und geschlechtsspezifische Faktoren die Expression dieses Transporters in Darmepithelzellen beeinflussen und welche Auswirkungen diese Veränderungen auf die Harnsäurespiegel und das kardiovaskuläre Risiko haben. Diese Daten sind auch für die Nierengesundheit wichtig, da eine gestörte Harnsäureausscheidung im Darm die Niere zusätzlich belasten kann, was das kardiovaskuläre Risiko weiter erhöht.